薬学部ゲノム病態解析講座の寺尾知可史特任教授(理化学研究所センターゲノム解析応用研究チームリーダー、静岡県立総合病院免疫研究部長)、石川優樹研究員、京都大学大学院医学研究科の夜久愛大学院生らの共同研究グループは、関節リウマチ患者の血中に見られる自己抗体[1]の一つであるIgG型リウマチ因子(IgG-RF)[2]の有無が、HLA-DRB1遺伝子[3]上のシェアドエピトープ(SE)[4]のアレル[5]の特定のパターンと関連することを発見しました。
本研究成果は、自己免疫疾患[1]の代表である関節リウマチの患者の病態進展予測や、患者ごとの病型に応じた治療戦略の開発に向けた研究に貢献すると期待できます。
今回、共同研究グループは、京都大学医学部附属病院に通院する関節リウマチ患者743名の血液サンプル中の自己抗体の有無と関節リウマチの強いリスクであるSEアレル[5]のパターンの関連を解析しました。その結果、IgG-RFの有無がSEアレルの特徴的なパターンと関連していることが分かりました。特に、IgG-RF陰性の患者は、これまで報告されている典型的なSEアレルパターンを示す患者群に集積していました。そのため、通常測定されているIgM型リウマチ因子(IgM-RF)[2]や抗環状シトルリン化ペプチド抗体(ACPA)[6]に加えて、IgG-RFを測定すれば、関節リウマチ患者の臨床的プロファイルを予測し、治療戦略に反映できると考えられます。
本研究は、科学雑誌『RHEUMATOLOGY(OXFORD)』オンライン版(11月15日付)に掲載されました。
本研究成果は、自己免疫疾患[1]の代表である関節リウマチの患者の病態進展予測や、患者ごとの病型に応じた治療戦略の開発に向けた研究に貢献すると期待できます。
今回、共同研究グループは、京都大学医学部附属病院に通院する関節リウマチ患者743名の血液サンプル中の自己抗体の有無と関節リウマチの強いリスクであるSEアレル[5]のパターンの関連を解析しました。その結果、IgG-RFの有無がSEアレルの特徴的なパターンと関連していることが分かりました。特に、IgG-RF陰性の患者は、これまで報告されている典型的なSEアレルパターンを示す患者群に集積していました。そのため、通常測定されているIgM型リウマチ因子(IgM-RF)[2]や抗環状シトルリン化ペプチド抗体(ACPA)[6]に加えて、IgG-RFを測定すれば、関節リウマチ患者の臨床的プロファイルを予測し、治療戦略に反映できると考えられます。
本研究は、科学雑誌『RHEUMATOLOGY(OXFORD)』オンライン版(11月15日付)に掲載されました。
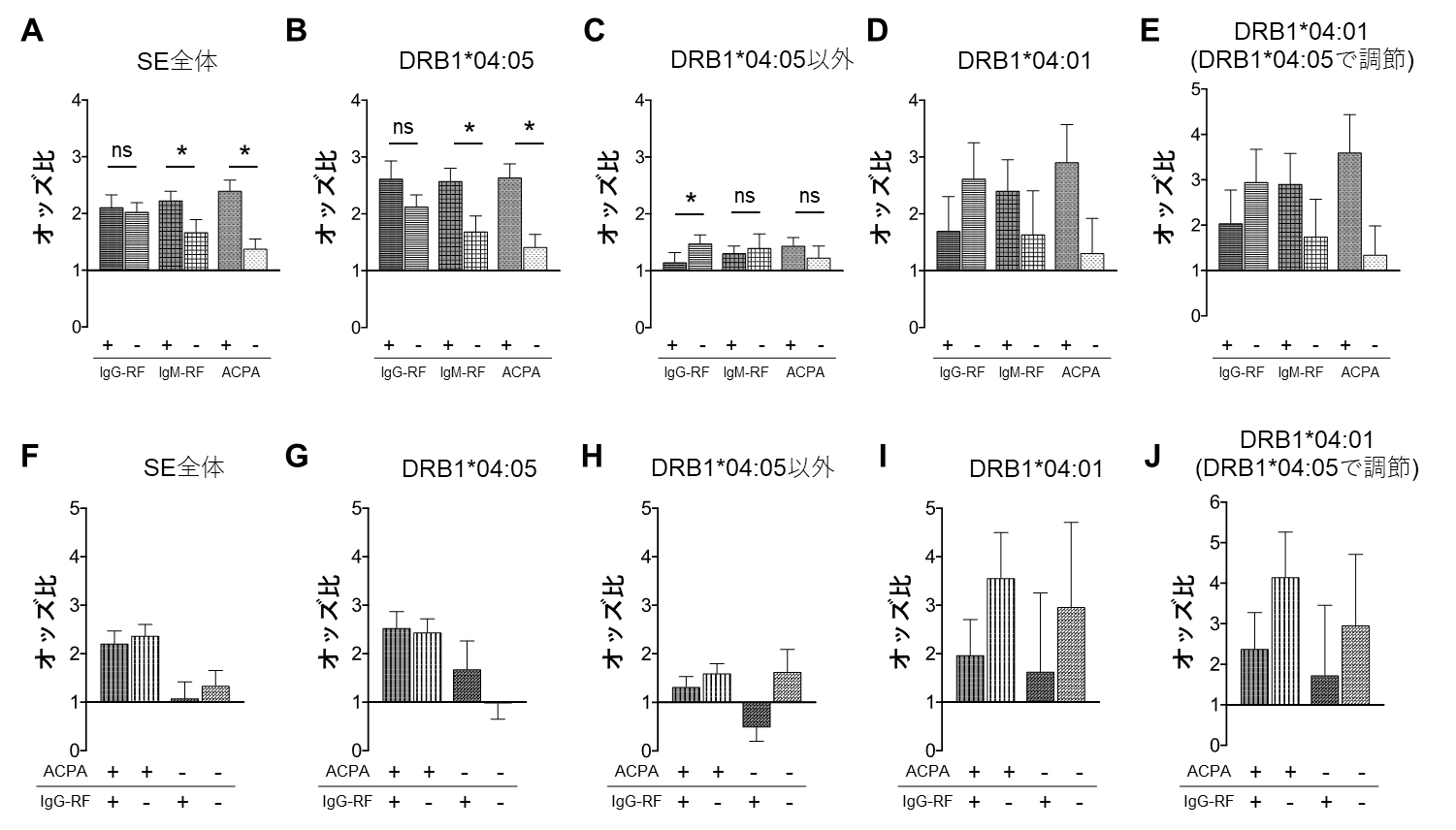
関節リウマチ患者における自己抗体とSEアレルパターンの関連
背景
関節リウマチの患者の血液中には、関節リウマチ特有の自己抗体と呼ばれるタンパク質がいくつか検出され、その中でも特にIgM型リウマチ因子(IgM-RF)と抗環状シトルリン化ペプチド抗体(ACPA)は、関節リウマチの診断における特異性の高さから、日常診療においてもよく測定されます。一方、これらの自己抗体は全ての関節リウマチ患者の血中で検出されるわけではなく、自己抗体の有無によって重症度や薬剤反応性などの臨床経過が異なることから、関節リウマチの中にさまざまな亜型(サブタイプ)が存在することが示唆されてきました。つまり、自己抗体の有無は、関節リウマチのサブタイプを区別するマーカーとして有用である可能性があります。
自己抗体の有無や臨床経過の違いを説明する一つの因子として、遺伝的多様性が挙げられ、実際に関節リウマチ患者における遺伝的差異による臨床像の違いがこれまで報告されてきました。その最たる例として、HLA-DRB1遺伝子上に存在するシェアドエピトープ(SE)のアレル(対立遺伝子)を持つ関節リウマチ患者においては、ACPAやIgM-RFが陽性であるばかりでなく高力価[7]であることが知られており、疾患活動性が高く将来の関節破壊のリスクが高いことが分かっています。
これらの研究は主にACPAやIgM-RFに着目したものであり、IgG型リウマチ因子(IgG-RF)をはじめとした他の自己抗体については、遺伝的な背景と臨床像との関連や臨床的意義はこれまでよく分かっていませんでした。そこで本研究では、ACPAやIgM-RF以外の関節リウマチ関連の自己抗体を含めた自己抗体プロファイルを行い,SEアレルパターンとの関連を調べる中で、特に特徴的であったIgG-RFに着目して臨床的意義を模索しました。
自己抗体の有無や臨床経過の違いを説明する一つの因子として、遺伝的多様性が挙げられ、実際に関節リウマチ患者における遺伝的差異による臨床像の違いがこれまで報告されてきました。その最たる例として、HLA-DRB1遺伝子上に存在するシェアドエピトープ(SE)のアレル(対立遺伝子)を持つ関節リウマチ患者においては、ACPAやIgM-RFが陽性であるばかりでなく高力価[7]であることが知られており、疾患活動性が高く将来の関節破壊のリスクが高いことが分かっています。
これらの研究は主にACPAやIgM-RFに着目したものであり、IgG型リウマチ因子(IgG-RF)をはじめとした他の自己抗体については、遺伝的な背景と臨床像との関連や臨床的意義はこれまでよく分かっていませんでした。そこで本研究では、ACPAやIgM-RF以外の関節リウマチ関連の自己抗体を含めた自己抗体プロファイルを行い,SEアレルパターンとの関連を調べる中で、特に特徴的であったIgG-RFに着目して臨床的意義を模索しました。
研究手法と成果
共同研究グループは、京都大学医学部附属病院免疫・膠原病内科に通院する関節リウマチ患者のうち同意の得られた743名について、関節リウマチに関連する自己抗体の測定結果を電子カルテより抽出しました。そして、患者から提供された血液検体中の細胞由来のDNAを用いて、HLA-DRB1遺伝子上のSEアレルパターンを解析しました。これらの情報は、個人が同定できないように全て匿名化されています。得られた情報を基に、自己抗体の有無とHLA-DRB1遺伝子のSEアレルパターンとの間に関連があるかどうかを、ロジスティック回帰分析モデル[8]を用いて検証しました。
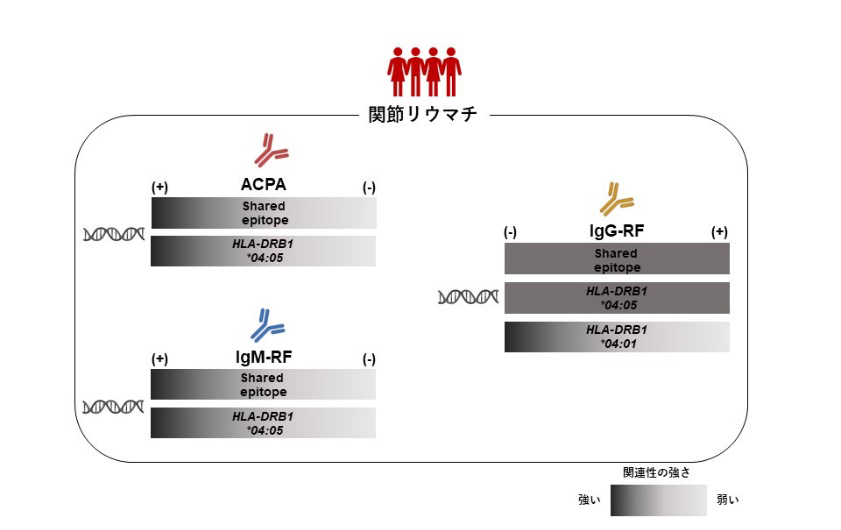
その結果、IgM-RFやACPAについてはこれまで知られていたのと同様に、DRB1*04:05(日本人を含むアジア人で最も頻度の高いSE)を持っている患者において有意に陽性率が高かったのに対して、IgG-RFについてはDRB1*04:05以外のSEを持っている患者で陰性率が高い傾向にありました(図1上段)。本研究で自己抗体との関連が認められたSEの中では、特に欧米人で頻度の高いSEであるDRB1*04:01がIgG-RF陰性患者で多い傾向にあり、この傾向はDRB1*04:05の影響を調節しても認められたことから、DRB1*04:01がDRB1*04:05とは独立してIgG-RF陰性の関節リウマチに関連していることが分かりました。
また、関節リウマチ患者では複数の自己抗体が血中に見られますが、IgM-RF陽性患者においては、IgG-RFとDRB1*04:01との関連は、ACPAの有無とは無関係であることも分かりました(図1下段)。
その結果、IgM-RFやACPAについてはこれまで知られていたのと同様に、DRB1*04:05(日本人を含むアジア人で最も頻度の高いSE)を持っている患者において有意に陽性率が高かったのに対して、IgG-RFについてはDRB1*04:05以外のSEを持っている患者で陰性率が高い傾向にありました(図1上段)。本研究で自己抗体との関連が認められたSEの中では、特に欧米人で頻度の高いSEであるDRB1*04:01がIgG-RF陰性患者で多い傾向にあり、この傾向はDRB1*04:05の影響を調節しても認められたことから、DRB1*04:01がDRB1*04:05とは独立してIgG-RF陰性の関節リウマチに関連していることが分かりました。
また、関節リウマチ患者では複数の自己抗体が血中に見られますが、IgM-RF陽性患者においては、IgG-RFとDRB1*04:01との関連は、ACPAの有無とは無関係であることも分かりました(図1下段)。
(上段)IgG-RF、IgM-RF、ACPAの有無とSE全体(A)、DRB1*04:05(B)、DRB1*04:05以外のSE(C)、DRB1*04:01(D)、DRB1*04:05の影響を除いた下でのDRB1*04:01(E)の関連を、健常人(SEを持たずいずれの自己抗体も陰性)と比較したときのオッズ比(疾患の発症や抗体が陽性などのリスクの大きさの指標)として示した。IgM-RF陽性やACPA陽性がSE全体、あるいはDRB1*04:05と有意な関連を示すのに対して、IgG-RFはDRB1*04:01と強い関連があり、DRB1*04:01がIgG-RF陰性のリスクであることが示された。
(下段)IgM-RF陽性患者をACPAの有無で分けた上で、SEとIgG-RFとの関連を上段図と同様に健常人と比較したときのオッズ比で示している。上段図で示されたSEとIgG-RFとの関連が、ACPAの影響とは無関係であることが分かる。
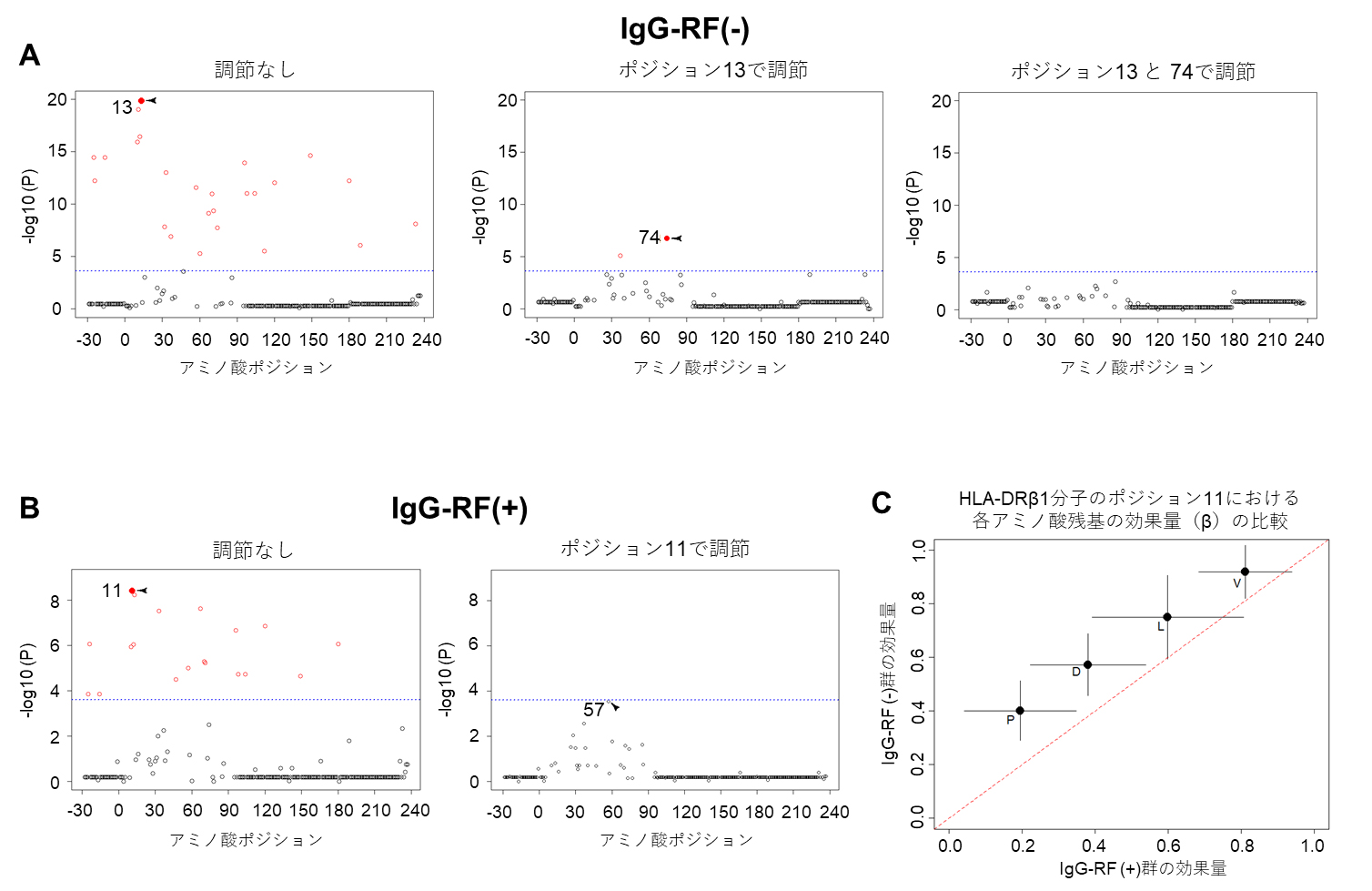
HLA[3]との関連を見るアプローチとして、上に述べたような特定のアレルとの関連を検証する以外に、HLA分子を構成するアミノ酸において多型(塩基配列の個体差)がある場所(ポジション、例:HLA-DRβ1の74番目のアミノ酸)との関連を検証する方法があります。HLA分子は、細胞やウイルス由来の非自己タンパク質(抗原)をHLA分子上に提示し、抗原特異的免疫反応を担うT細胞[9]へ信号を送ることで免疫反応を誘導します。関節リウマチを含む多くの自己免疫疾患においては、非自己の抗原でなく、自己由来の抗原が提示されることが病態の形成に関わっており、抗原との親和性があるHLA分子のアミノ酸ポジション、およびそのポジションにおけるアミノ酸残基の解析が病態の解明に有用です。
関節リウマチにおいても、既に特定のポジション(11、13、74番目)におけるアミノ酸残基との関連が分かっていることから、IgG-RFのプロファイルとアミノ酸残基との関連を検証することで、“典型的な関節リウマチらしさ”を検討しました(図2)。すると、IgG-RF陽性患者、IgG-RF陰性患者ともにHLA分子の11、13、74番目のアミノ酸残基と強い関連が示され、アミノ酸残基との関連においてはどちらも典型的な関節リウマチらしさを示したといえます。ここでいう典型的な関節リウマチらしさとは、上述のアミノ酸残基と関連を示し、IgM-RF陽性およびACPA陽性を呈する、関節破壊のリスクが高い関節リウマチであることも意味します。しかし、IgG-RF陽性患者、IgG-RF陰性患者の両方で強い関連を示したポジション11における効果量[10]の大きさを比較すると、IgG-RF陰性患者の方が大きいことが分かり、IgG-RF陰性患者の方がより典型的な関節リウマチらしいことが明らかになりました。
(下段)IgM-RF陽性患者をACPAの有無で分けた上で、SEとIgG-RFとの関連を上段図と同様に健常人と比較したときのオッズ比で示している。上段図で示されたSEとIgG-RFとの関連が、ACPAの影響とは無関係であることが分かる。
HLA[3]との関連を見るアプローチとして、上に述べたような特定のアレルとの関連を検証する以外に、HLA分子を構成するアミノ酸において多型(塩基配列の個体差)がある場所(ポジション、例:HLA-DRβ1の74番目のアミノ酸)との関連を検証する方法があります。HLA分子は、細胞やウイルス由来の非自己タンパク質(抗原)をHLA分子上に提示し、抗原特異的免疫反応を担うT細胞[9]へ信号を送ることで免疫反応を誘導します。関節リウマチを含む多くの自己免疫疾患においては、非自己の抗原でなく、自己由来の抗原が提示されることが病態の形成に関わっており、抗原との親和性があるHLA分子のアミノ酸ポジション、およびそのポジションにおけるアミノ酸残基の解析が病態の解明に有用です。
関節リウマチにおいても、既に特定のポジション(11、13、74番目)におけるアミノ酸残基との関連が分かっていることから、IgG-RFのプロファイルとアミノ酸残基との関連を検証することで、“典型的な関節リウマチらしさ”を検討しました(図2)。すると、IgG-RF陽性患者、IgG-RF陰性患者ともにHLA分子の11、13、74番目のアミノ酸残基と強い関連が示され、アミノ酸残基との関連においてはどちらも典型的な関節リウマチらしさを示したといえます。ここでいう典型的な関節リウマチらしさとは、上述のアミノ酸残基と関連を示し、IgM-RF陽性およびACPA陽性を呈する、関節破壊のリスクが高い関節リウマチであることも意味します。しかし、IgG-RF陽性患者、IgG-RF陰性患者の両方で強い関連を示したポジション11における効果量[10]の大きさを比較すると、IgG-RF陰性患者の方が大きいことが分かり、IgG-RF陰性患者の方がより典型的な関節リウマチらしいことが明らかになりました。
HLA-DRβ1分子中のアミノ酸ポジションとIgG-RF陰性患者(A)あるいは陽性患者(B)との関連解析結果から、既知の関節リウマチ関連ポジションである11、13、74番目のアミノ酸との関連が示された。IgG-RF陰性患者と陽性患者の両方で関連の強かったポジション11における各アミノ酸の効果量の比較(C)においては、IgG-RF陰性患者で有意に高いことが示された。
研究グループは2019年、本研究とは独立したサンプルで解析した研究で、IgM-RFが関節リウマチ発症前後で常に陽性である群(常時IgM-RF+群)と、陰性から陽性、あるいは陽性から陰性に変化する群(IgM-RF陽転/陰転群)とを比較したところ、IgM-RF陽転/陰転群がSEとの関連が強いとともにアミノ酸ポジション11との関連も認められ、より典型的な関節リウマチらしさを呈することを示しました注1)。
そこで、図2で示した結果を踏まえて、常時IgM-RF+群とIgM-RF陽転/陰転群におけるIgG-RF陽性患者とIgG-RF陰性患者の割合を比較しました(図3)。IgG-RF陰性患者(図3の橙色)はIgM-RF陽転/陰転群により集積しており、これは図2Cで示した効果量の比較とよく合う結果であり、改めてIgG-RF陰性患者はIgG-RF陽性患者と比べて、より典型的な関節リウマチらしいことを確認しました。これはIgM-RFに加えてIgG-RFを測定することで、患者を抗体プロファイルに基づいたリスクに応じて層別化できる可能性を示しています。
研究グループは2019年、本研究とは独立したサンプルで解析した研究で、IgM-RFが関節リウマチ発症前後で常に陽性である群(常時IgM-RF+群)と、陰性から陽性、あるいは陽性から陰性に変化する群(IgM-RF陽転/陰転群)とを比較したところ、IgM-RF陽転/陰転群がSEとの関連が強いとともにアミノ酸ポジション11との関連も認められ、より典型的な関節リウマチらしさを呈することを示しました注1)。
そこで、図2で示した結果を踏まえて、常時IgM-RF+群とIgM-RF陽転/陰転群におけるIgG-RF陽性患者とIgG-RF陰性患者の割合を比較しました(図3)。IgG-RF陰性患者(図3の橙色)はIgM-RF陽転/陰転群により集積しており、これは図2Cで示した効果量の比較とよく合う結果であり、改めてIgG-RF陰性患者はIgG-RF陽性患者と比べて、より典型的な関節リウマチらしいことを確認しました。これはIgM-RFに加えてIgG-RFを測定することで、患者を抗体プロファイルに基づいたリスクに応じて層別化できる可能性を示しています。
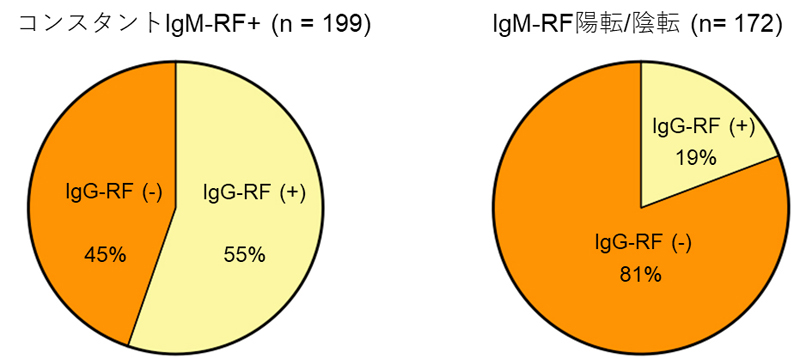
図3 IgG-RF陽性・陰性患者の観察期間中におけるIgM-RF陽性/陰性変化の有無
IgG-RF陽性患者(黄色)とIgG-RF陰性患者(橙色)が、本研究の観察期間中にIgM-RFが常に陽性であったか(左)、陽性から陰性、あるいは陰性から陽性に変化したのか(右)を比較した。常時IgM-RF+群では、IgG-RF陽性患者がIgG-RF陰性患者よりもやや多いのに対して、IgM-RF陽転/陰転群ではIgG-RF陰性患者がIgG-RF陽性患者の4倍以上であることが分かった。
注1)Hiwa, R., et al. HLA-DRB1 Analysis Identified a Genetically Unique Subset within Rheumatoid Arthritis and Distinct Genetic Background of Rheumatoid Factor Levels from Anticyclic Citrullinated Peptide Antibodies1. J. Rheumatol (2019)
注1)Hiwa, R., et al. HLA-DRB1 Analysis Identified a Genetically Unique Subset within Rheumatoid Arthritis and Distinct Genetic Background of Rheumatoid Factor Levels from Anticyclic Citrullinated Peptide Antibodies1. J. Rheumatol (2019)
今後の期待
本研究により、これまでほとんど分かっていなかった日本人関節リウマチ患者におけるIgG-RFの有無に関するHLA-DRB1遺伝子、特にSEとの関連が明らかになりました。IgG-RFのプロファイルにより関節リウマチ患者が特徴的な遺伝的背景を持つことが示唆され、さらにIgG-RF陰性患者ではより活動性の高い関節リウマチである可能性が示されました。
IgM-RFやACPAと将来の関節破壊との関連はよく知られており、治療方針の決定因子として考慮されています。本研究の大きな意義は、今後、これらの自己抗体に加えてIgG-RFを測定することで、遺伝的背景に基づいたリスク評価による患者の層別化と、治療方針の決定に有用である可能性が示されたことです。本研究は、日本におけるより多くの関節リウマチ患者や、さらには海外の患者の治療戦略に向けた研究につながるものと期待できます。
IgM-RFやACPAと将来の関節破壊との関連はよく知られており、治療方針の決定因子として考慮されています。本研究の大きな意義は、今後、これらの自己抗体に加えてIgG-RFを測定することで、遺伝的背景に基づいたリスク評価による患者の層別化と、治療方針の決定に有用である可能性が示されたことです。本研究は、日本におけるより多くの関節リウマチ患者や、さらには海外の患者の治療戦略に向けた研究につながるものと期待できます。
論文情報
<タイトル>
Genetic architecture underlying IgG-RF production is distinct from that of IgM-RF
<著者名>
Ai Yaku, Yuki Ishikawa, Takeshi Iwasaki, Ryosuke Hiwa, Keitaro Matsuo, Hiroh Saji, Kimiko Yurugi, Yasuo Miura, Moritoshi Furu, Hiromu Ito, Takao Fujii, Taira Maekawa, Motomu Hashimoto, Koichiro Ohmura, Tsuneyo Mimori, Chikashi Terao
<雑誌>
RHEUMATOLOGY(OXFORD)
<DOI>
10.1093/rheumatology/keac593
(クリックすると出版社サイトへ移動します)
Genetic architecture underlying IgG-RF production is distinct from that of IgM-RF
<著者名>
Ai Yaku, Yuki Ishikawa, Takeshi Iwasaki, Ryosuke Hiwa, Keitaro Matsuo, Hiroh Saji, Kimiko Yurugi, Yasuo Miura, Moritoshi Furu, Hiromu Ito, Takao Fujii, Taira Maekawa, Motomu Hashimoto, Koichiro Ohmura, Tsuneyo Mimori, Chikashi Terao
<雑誌>
RHEUMATOLOGY(OXFORD)
<DOI>
10.1093/rheumatology/keac593
(クリックすると出版社サイトへ移動します)
補足説明
[1] 自己抗体、自己免疫疾患
抗体は、主に細菌やウイルスなどの外来の異物(抗原)を排除する目的で産生されるタンパク質であり、ワクチンや疾患の治療にも使用される。しかし、自分の体由来の物質を異物として認識する抗体が産生されることがあり、これを自己抗体と呼ぶ。自己免疫疾患は免疫システムに異常が生じ、自己の正常な組織に障害を与える疾患の総称。自己抗体は、関節リウマチをはじめとした種々の自己免疫疾患で認められ、診断や治療経過のモニターに使用される。
[2] IgG型リウマチ因子(IgG-RF)、IgM型リウマチ因子(IgM-RF)
リウマチ因子(RF)は、関節リウマチで認められる自己抗体の一つ。IgM(免疫グロブリンM)型リウマチ因子はAPCAよりも特異性が低いが、診断において参照される。ACPA同様に、IgM型リウマチ因子の高値は関節破壊のリスクであることが知られている。本研究では、IgG(免疫グロブリンG)型リウマチ因子に着目し、研究を行った。RFはrheumatoid factorの略。
[3] HLA-DRB1遺伝子、HLA
HLA(ヒト白血球抗原:human leukocyte antigen)は白血球の表面に発現する分子で、白血球の血液型を規定する。HLAの表面に提示された抗原はT細胞受容体によって認識される。HLA-DRB1遺伝子は、タンパク質HLA-DRβ1をコードするHLAの遺伝子の一つ。HLAは多様性に富んでおり、外来抗原に対する多様な免疫応答において重要である一方で、その多様性が関節リウマチを含む種々の自己免疫疾患と関連することが分かっている。
[4] シェアドエピトープ(SE)
タンパク質HLA-DRβ1のうち、共通の70~74番目のアミノ酸配列(ペプチド)パターン示す群が存在する。そのアミノ酸配列をシェアドエピトープ(SE)と呼ぶ。SEはACPA陽性・RF陽性の関節リウマチの発症やACPA高値と強く関連しており、関節リウマチの病態形成上重要な遺伝的因子である。SEはshared epitopeの略。
[5] アレル、SEアレル
ヒトをはじめとした2倍体と呼ばれる生物では、母親由来と父親由来の染色体を受け継ぐため、異なる遺伝情報を持つ二つの対遺伝子が存在しており、この対遺伝子を対立遺伝子あるいはアレルとよぶ。SEアレルは、SEを持つHLA-DRB1遺伝子のことを指す。仮に、複数あるSEアレルをA、B、C(実際には三つ以上ある)、SEアレルでないものをXとしたとき、両親から受け継ぐアレルによって、子のアレルはAA、AB、AC、AX、BB、BC、BX、CC、CXといった異なる組み合わせが存在し得ることになる。
[6] 抗環状シトルリン化ペプチド抗体(ACPA)
関節リウマチで認められる自己抗体の一つであり、特異性が高いことから診断に使用される。ACPA高値は、関節破壊のリスクであることが知られている。ACPAはanti-citrullinated cyclic peptide/protein antibodyの略。
[7] 高力価
自己抗体などの臨床検査値において特に高い値を示す場合に用いる用語。ここではACPAの値が高いことを示している。
[8] ロジスティック回帰分析モデル
一つ(単変量)あるいは複数(多変量)の説明(独立)変数を用いて、特定の目的(従属)変数を予測する解析方法の一つであり、医学統計で度々使用される。目的(従属)変数は、「ACPA陽性・ACPA陰性」などの名義変数である。
[9] T細胞
免疫担当細胞の一種。HLA分子上に提示されたタンパク抗原を、T細胞表面上の受容体を介して認識して活性化し、獲得免疫と呼ばれる抗原特異的な免疫反応を担う。T細胞受容体は多様性に富んでおり、多様な外来抗原に応答することで生体防御を担っているが、自己に反応するT細胞集団が何らかの原因で増えることで、自己免疫応答および自己免疫疾患の発症に関連することが分かっている。
[10] 効果量
疾患の発症や抗体が陽性などのリスクの大きさの指標をオッズ比という。オッズ比の自然対数をとったものを効果量と呼び通常βと示される。リニアモデルにおいては直線の傾きに相当しており,傾きが大きいほどリスクが高い。ロジスティック回帰モデルにおいても同様の解釈で考えることができる。
抗体は、主に細菌やウイルスなどの外来の異物(抗原)を排除する目的で産生されるタンパク質であり、ワクチンや疾患の治療にも使用される。しかし、自分の体由来の物質を異物として認識する抗体が産生されることがあり、これを自己抗体と呼ぶ。自己免疫疾患は免疫システムに異常が生じ、自己の正常な組織に障害を与える疾患の総称。自己抗体は、関節リウマチをはじめとした種々の自己免疫疾患で認められ、診断や治療経過のモニターに使用される。
[2] IgG型リウマチ因子(IgG-RF)、IgM型リウマチ因子(IgM-RF)
リウマチ因子(RF)は、関節リウマチで認められる自己抗体の一つ。IgM(免疫グロブリンM)型リウマチ因子はAPCAよりも特異性が低いが、診断において参照される。ACPA同様に、IgM型リウマチ因子の高値は関節破壊のリスクであることが知られている。本研究では、IgG(免疫グロブリンG)型リウマチ因子に着目し、研究を行った。RFはrheumatoid factorの略。
[3] HLA-DRB1遺伝子、HLA
HLA(ヒト白血球抗原:human leukocyte antigen)は白血球の表面に発現する分子で、白血球の血液型を規定する。HLAの表面に提示された抗原はT細胞受容体によって認識される。HLA-DRB1遺伝子は、タンパク質HLA-DRβ1をコードするHLAの遺伝子の一つ。HLAは多様性に富んでおり、外来抗原に対する多様な免疫応答において重要である一方で、その多様性が関節リウマチを含む種々の自己免疫疾患と関連することが分かっている。
[4] シェアドエピトープ(SE)
タンパク質HLA-DRβ1のうち、共通の70~74番目のアミノ酸配列(ペプチド)パターン示す群が存在する。そのアミノ酸配列をシェアドエピトープ(SE)と呼ぶ。SEはACPA陽性・RF陽性の関節リウマチの発症やACPA高値と強く関連しており、関節リウマチの病態形成上重要な遺伝的因子である。SEはshared epitopeの略。
[5] アレル、SEアレル
ヒトをはじめとした2倍体と呼ばれる生物では、母親由来と父親由来の染色体を受け継ぐため、異なる遺伝情報を持つ二つの対遺伝子が存在しており、この対遺伝子を対立遺伝子あるいはアレルとよぶ。SEアレルは、SEを持つHLA-DRB1遺伝子のことを指す。仮に、複数あるSEアレルをA、B、C(実際には三つ以上ある)、SEアレルでないものをXとしたとき、両親から受け継ぐアレルによって、子のアレルはAA、AB、AC、AX、BB、BC、BX、CC、CXといった異なる組み合わせが存在し得ることになる。
[6] 抗環状シトルリン化ペプチド抗体(ACPA)
関節リウマチで認められる自己抗体の一つであり、特異性が高いことから診断に使用される。ACPA高値は、関節破壊のリスクであることが知られている。ACPAはanti-citrullinated cyclic peptide/protein antibodyの略。
[7] 高力価
自己抗体などの臨床検査値において特に高い値を示す場合に用いる用語。ここではACPAの値が高いことを示している。
[8] ロジスティック回帰分析モデル
一つ(単変量)あるいは複数(多変量)の説明(独立)変数を用いて、特定の目的(従属)変数を予測する解析方法の一つであり、医学統計で度々使用される。目的(従属)変数は、「ACPA陽性・ACPA陰性」などの名義変数である。
[9] T細胞
免疫担当細胞の一種。HLA分子上に提示されたタンパク抗原を、T細胞表面上の受容体を介して認識して活性化し、獲得免疫と呼ばれる抗原特異的な免疫反応を担う。T細胞受容体は多様性に富んでおり、多様な外来抗原に応答することで生体防御を担っているが、自己に反応するT細胞集団が何らかの原因で増えることで、自己免疫応答および自己免疫疾患の発症に関連することが分かっている。
[10] 効果量
疾患の発症や抗体が陽性などのリスクの大きさの指標をオッズ比という。オッズ比の自然対数をとったものを効果量と呼び通常βと示される。リニアモデルにおいては直線の傾きに相当しており,傾きが大きいほどリスクが高い。ロジスティック回帰モデルにおいても同様の解釈で考えることができる。
共同研究グループ
理化学研究所 生命医科学研究センター ゲノム解析応用研究チーム
チームリーダー 寺尾 知可史(テラオ・チカシ)
(静岡県立総合病院 免疫研究部長、静岡県立大学 特任教授)
研究員 石川 優樹(イシカワ・ユウキ)
京都大学大学院 医学研究科
内科学講座 臨床免疫学
大学院生 夜久 愛(ヤク・アイ)
研究生 岩崎 毅 (イワサキ・タケシ)
助教 日和 良介(ヒワ・リョウスケ)
講師 吉藤 元(ヨシフジ・ハジメ)
助教授(研究当時) 大村 浩一郎(オオムラ・コウイチロウ)
教授(研究当時) 三森 経世(ミモリ・ツネヨ)
リウマチ性疾患先進医療学
助教(研究当時) 布留 盛敏(フル・モリトシ)
講師(研究当時) 橋本 求(ハシモト・モトム)
准教授(研究当時) 伊藤 宣(イトウ・ヒロム)
教授(研究当時) 藤井 隆夫(フジイ・タカオ)
京都大学 医学部 附属病院細胞療法センター
主任検査技師 万木 紀美子(ユルギ・キミコ)
助教(研究当時) 三浦 康生(ミウラ・ヤスオ)
教授(研究当時) 前川 平(マエカワ・タイラ)
愛知がんセンター研究所 がん予防研究分野
分野長 松尾 恵太郎(マツオ・ケイタロウ)
HLA研究所
理事長・所長 佐治 博夫(サジ・ヒロオ)
チームリーダー 寺尾 知可史(テラオ・チカシ)
(静岡県立総合病院 免疫研究部長、静岡県立大学 特任教授)
研究員 石川 優樹(イシカワ・ユウキ)
京都大学大学院 医学研究科
内科学講座 臨床免疫学
大学院生 夜久 愛(ヤク・アイ)
研究生 岩崎 毅 (イワサキ・タケシ)
助教 日和 良介(ヒワ・リョウスケ)
講師 吉藤 元(ヨシフジ・ハジメ)
助教授(研究当時) 大村 浩一郎(オオムラ・コウイチロウ)
教授(研究当時) 三森 経世(ミモリ・ツネヨ)
リウマチ性疾患先進医療学
助教(研究当時) 布留 盛敏(フル・モリトシ)
講師(研究当時) 橋本 求(ハシモト・モトム)
准教授(研究当時) 伊藤 宣(イトウ・ヒロム)
教授(研究当時) 藤井 隆夫(フジイ・タカオ)
京都大学 医学部 附属病院細胞療法センター
主任検査技師 万木 紀美子(ユルギ・キミコ)
助教(研究当時) 三浦 康生(ミウラ・ヤスオ)
教授(研究当時) 前川 平(マエカワ・タイラ)
愛知がんセンター研究所 がん予防研究分野
分野長 松尾 恵太郎(マツオ・ケイタロウ)
HLA研究所
理事長・所長 佐治 博夫(サジ・ヒロオ)